Phasen der Produktentwicklung
Wir begleiten Sie in der Produktentwicklung von der ersten technischen Zeichnung bis zur Konzeption des gesamten Produkts. Wir erstellen gemeinsam mit Ihnen ein Lastenheft für die Entwicklung, welches alle Anforderungen zusammenfasst. Vor Projektstart ermitteln wir im Rahmen von Erstgesprächen in Ihrem Hause und, falls erforderlich, mit Machbarkeitsstudien benötigten Zeitraum und Ressourcen für Ihr Vorhaben.
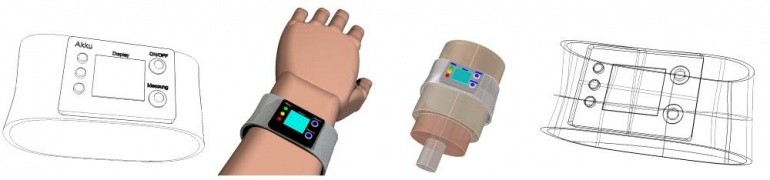
Im interdisziplinären Team begleiten wir Sie durch die technische Vorentwicklung, die Produktentwicklung sowie die Serieneinführung und Fertigung Ihres Produkts. Im Rahmen der Produktentwicklung arbeiten wir interdisziplinär mit weiteren Abteilungen der senetics healthcare group zusammen.
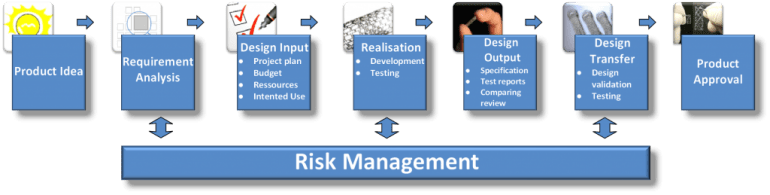
Ihr Produkt wird folgende Phasen durchlaufen, durch welche wir Sie durchgehend umfassend unterstützen können:
Haben Sie eine Idee für ein Produkt, aber kennen die genauen technischen Anforderungen nicht? Diese können wir im Rahmen der Vorentwicklung und Entwicklungsplanung gemäß ISO 13485 ermitteln. Mit den Ergebnissen lässt sich die Entwicklung Ihres Produkts sehr gut planen.
- Anforderungsanalyse: Im Rahmen von Workshops ermitteln wir mit Ihnen alle Anforderungen für das Produkt
- Stand der Technik-Analyse und Beratung bei der Patentierung: Sind Innovationen die Basis für die Entwicklung, sollte eine Patentierung zeitnah begonnen werden. Wir unterstützen Sie dabei.
- Entwurf für ein anwenderfreundliches Produktdesign: Medizinische Produkte müssen benutzerfreundlich konzipiert werden. Wir erarbeiten mit Ihnen nutzerfreundliche Designs.
- Strategie für die Zulassung: Medizinische Produkte können auf vielfältige Weise auf den Markt gebracht werden. Aufgrund der regulatorischen Anforderungen ist dies nicht einfach. Wir unterstützen Sie bei der Planung.
Weitere Infos finden Sie auf diesem Link zu Produktinnovation und Machbarkeit.
Die technische Entwicklung Ihres Produkts erfolgt in definierten Entwicklungszyklen. Wir berücksichtigen bereits in frühen Phasen der Entwicklung die Zielanwendung und die Zulassung.
- Systemarchitektur
- Spezifikation von Modulen und Baugruppen
- Implementierung eines Designs
- Verifizierung von Modulen und des Gesamtsystems
- Begleitende Technische Dokumentation gemäß MDR und IVDR
- Erstellung der Risikomanagementakte gemäß DIN EN ISO 14971
- Software-Dokumentation gemäß DIN EN 62304
Weiter Informationen finden Sie unter diesem Link zur Dokumentation für Produktzulassung.
Eine Produktentwicklung ist im allgemeinen sehr lohnenswert, erfordert jedoch eine gute Planung der Phase zur Validierung und Verifizierung. Gerade bei Medizinprodukten gilt es einige Punkte zu beachten. Hierbei sollte deutlich zwischen Verifizierung und Validierung unterschieden werden.
Verifizierung überprüft, ob alle messbaren Anforderungen eingehalten wurden. Dies übernehmen wir für Sie für jede Auftragsentwicklung. In jedem Fall nehmen wir dazu Funktionstests und Sichtprüfungen zur Hilfe. Zudem sind weitere, spezifische Prüfungen für nahezu jede Entwicklung erforderlich bzw. zu empfehlen:
- Prüfung der biologischen Sicherheit gemäß ISO 10993
- Überprüfung der Abnutzung durch Dauereinsatz mit Hilfe von Abriebtests
- Prüfung der funktionalen Sicherheit elektrischer Geräte gemäß EN 60601-1
- Prüfung der elektromagnetischen Verträglichkeit gemäß EN 60601-1-2
- Transportvalidierung inklusive Klimaprüfung, Rütteltest, Falltest
Validierung beantwortet die Frage, ob das Produkt für die Zielanwender geeignet ist. Gemäß MDD\/MDR ist für nahezu alle medizinischen Geräte eine Usability-Studie und eine klinische Bewertung verpflichtend, womit diese Frage umfassend beantwortet werden kann. Wir unterstützen Sie hierbei mit folgenden Leistungen:
- Fertigung von Prototypen für eine klinische Prüfung
- Durchführung einer Usability-Studie gemäß ISO 62366
- Durchführung einer klinischen Bewertung
- Beratung bei der Durchführung einer klinischen Prüfung
Weiter Informationen finden Sie unter diesem Link zu Verifizierung und Validierung.
Ist der Design-Prozess abgeschlossen, so können wir Sie damit unterstützen, das Design in eine Serienfertigung zu überführen. Für einzelne Produktgruppen können wir die Serienfertigung auch direkt für Sie durchführen. Der Design Transfer beinhaltet:
- Definition des Fertigungsprozesses
- Definition der Endprüfung
- Auswahl und Qualifizierung von Lieferanten
- Erstellung der Stückliste für Ihr Produkt
- Erstellung von Arbeitsanweisungen gemäß ISO 13485
- Fertigung von Werkzeugen
Weitere Informationen finden Sie unter diesem Link zur Fertigung.
Die Herstellung von medizinischen Produkten erfordert die Erfüllung hoher Bestimmungen, hauptsächlich der Europäischen Medizinprodukteverordnung und der US-amerikanischen Food and Drug Administration (FDA). Daher fertigen wir ausschließlich gemäß DIN EN ISO 13485. Ob Sie bei uns nun medizinische Produkte oder Produkte für nicht-medizinische Anwendungen fertigen möchten: Wir garantieren Ihnen beste Qualität!
Wir sind auf kleine und mittlere Losgrößen ausgerichtet. Bei der Losproduktion wird ein Produktionsauftrag, eben das Los, geschlossen durch die verschiedenen Stufen der Fertigung durchgeführt. Dies kann je nach Produkt auch teilautomatisiert geschehen. In der Pilotserie werden die Prozesse an ersten Mustern erprobt. Die Auflage des jeweiligen Loses ist mit Rüstkosten verbunden.
Folgende Leistungen bieten wir Ihnen:
- erienfertigung: Losfertigung, Chargenfertigung
- Eigenfertigung: Montage des Produkts, Teilefertigung
- Arbeitsplatzplanung
- Lieferplan, Personalplanung
Weitere Informationen finden Sie unter diesem Link zur Serienfertigung.
