IEC 62304 Medizingeräte-Software – Software-Lebenszyklus-Prozesse
Software spielt bei modernen Technologien eine nicht mehr wegzudenkende Rolle, da sie wesentliche Aufgaben wie z.B. Kommunikation, Steuerung von Hardware oder Auswertung und Analyse von Daten übernimmt. Folglich ist sie auch ein bedeutsamer Bestandteil vieler medizinischer Geräte bzw. Methoden, weshalb hier mittels europäischer Norm besondere Anforderungen an Medizingeräte-Softwares gestellt sind.
senetics bietet Ihnen die Software-Entwicklung gemäß IEC 62304 an und die entsprechende Beratung dazu.
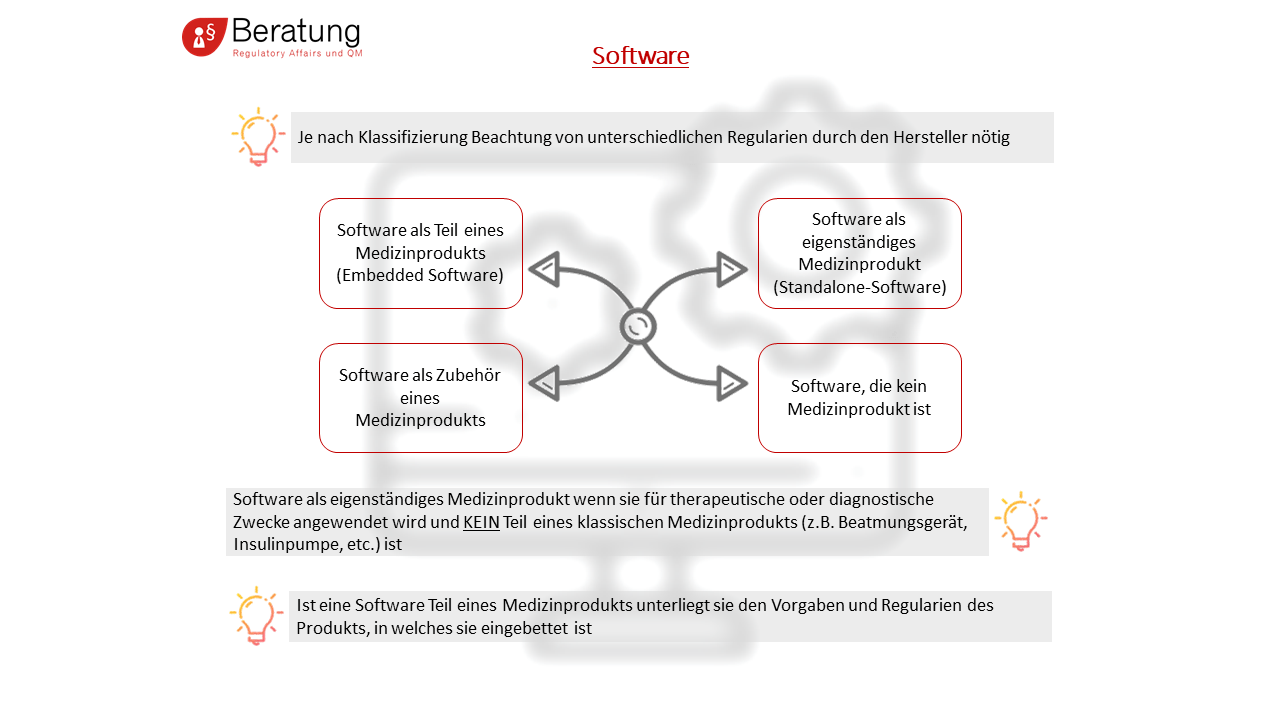
Die IEC 62304 ist eine europäische Norm für Medizingeräte-Software. Diese Norm definiert Anforderungen an Prozesse des Software-Lebenszyklus von Medizinprodukte-Software, die von Medizinprodukteherstellern als Mindeststandard und nicht als Vorgabe einer Vorgehensweise zu betrachten sind. Sie gilt für den gesamten Lebenszyklus der Software, d.h. von der Entwicklung über die Wartung der Software bis hin zur Lösung von Softwareproblemen. Dabei unterscheidet die IEC 62304 nicht, ob es sich bei der Software um ein eigenständiges Medizinprodukt handelt, ob diese eingebettet ist oder einen integralen Bestandteil eines Medizinproduktes darstellt.
Allgemeine Anforderungen an Medizingeräte-Software
Grundsätzlich fordert die IEC 62304, dass ein Qualitätsmanagementsystem nach der ISO 13485 eingeführt und aufrechterhalten wird und, dass zusätzlich ein Risikomanagement-Prozess nach der ISO 14971 durchgeführt wird.
Sicherheitsklassen
Des Weiteren führt die Norm Software-Sicherheitsklassen ein. Durch diese soll gewährleistet sein, dass die Software-Lebenszyklus-Prozesse für eine große Bandbreite an Medizinprodukte-Software anpassbar ist. Die Sicherheitsklassen A, B und C definieren sich anhand der Schwere eines potentiellen Schadens durch die Software. So trägt Software der Klasse A definitionsgemäß entweder zu keiner Gefährdung oder zu einer Gefährdungssituation mit einem vertretbaren Risiko bei. Bei Software der Klasse B kann es zu einer Gefährdungssituation mit unvertretbarem Risiko einschließlich eines Schadens ohne schwere Verletzungen kommen. Software der Klasse C kann zu Gefährdungssituationen mit schweren Verletzungen oder Tod führen.
Software-Lebenszyklus-Prozesse
Die IEC 62304 schreibt Medizinprodukteherstellern die fünf Prozesse vor, nach welchen Software entwickelt werden soll.
- Planung der Software-Entwicklung,
- Software-Wartungs-Prozess,
- Software-Risikomanagement-Prozess,
- Software-Konfigurationsmanagement-Prozess,
- Problemlösungs-Prozess für Software
Medizinische elektrische Geräte IEC 60601
Die EN 60601-1 ist die Basisnorm für medizinische elektrische Geräte und regelt die „Allgemeine(n) Festlegungen für die Sicherheit einschließlich der wesentlichen Leistungsmerkmale“. Der Anwendungsbereich der EN 60601 ist wie folgt definiert: „Diese Internationale Norm gilt für die Basissicherheit und die wesentlichen Leistungsmerkmale von medizinischen elektrischen Geräten und medizinischen elektrischen Systemen (…)“.
Die Normenreihe gilt nicht für:
- „In-vitro-Diagnosegeräte, die nicht unter den Begriff ME-GERÄT fallen; diese Geräte sind in der Normenreihe IEC 61010 [61] behandelt;
- implantierbare Teile von aktiven implantierbaren Medizingeräten, die in der Normenreihe ISO 14708[69] behandelt werden;
- medizinische Gasversorgungssysteme, die in ISO 7396-1 [68] behandelt werden.“
Die EN 60601 Normenreihe ist die Entsprechung der internationalen Norm IEC 60601 und umfasst zahlreiche Ergänzungsnormen (60601-1-XX) und besondere Festlegungen (60601-2-XX). Bei der Anwendung dieser Normenreihe ist darauf zu achten, dass sich alle angewendeten Ergänzungsnormen und besondere Festlegungen auf dieselbe Ausgabe der EN 60601-1 beziehen!
Seit 2009 werden Normen, die auf internationaler Ebene von ISO und IEC zusammen erstellt werden, mit 80 beginnend nummeriert (80601). Normen, die unter der bisherigen Nummerierung 60601 erschienen sind, werden unter der bestehenden Nummerierung weitergeführt. Daher kann es im Rahmen der Umstellung zu Doppelbezeichnungen kommen.

Mit senetics sind Sie auf der sicheren Seite.
Kommen Sie gerne auf uns zu, wir unterstützen Sie bei Ihrem Anliegen!
